| Př. 1: Kolik gramů chloridu barnatého musíme vzít pro získání 20 g síranu barnatého? |
| molekulová hmotnost BaCl2 | . . . | 208,23 u |
| molekulová hmotnost BaSO4 | . . . | 185,79 u |
| 1 mol BaCl2 váží | . . . | 208,23 g |
| 1 mol BaSO4 váží | . . . | 185,79 g |
| 208,23 g BaCl2 | . . . | 185,79 g BaSO4 |
| x g BaCl2 . . . . | . . . | 20 g BaSO4 |
| x = 22,42 g | ||
| Př. 2: Kolik gramů hydroxidu měďnatého můžeme získat z 30 g síranu měďnatého? |
| molekulová hmotnost CuSO4 | . . . | 159,6 u |
| molekulová hmotnost Cu(OH)2 | . . . | 97,56 u |
| 1 mol CuSO4 váží | . . . | 159,6 g |
| 1 mol Cu(OH)2 váží | . . . | 97,56 g |
| 159,6 g CuSO4 | . . . | 97,56 g Cu(OH)2 |
| 30 g CuSO4 | . . . | x g Cu(OH)2 |
| x = 18,34 g Cu(OH)2 | ||
| Př. 3: Kolika litry oxidu uhličitého se musí nasytit roztok louhu, aby se vytvořilo 60 g uhličitanu sodného? |
| molekulová hmotnost CO2 . . . | . . . . | 44,01 u |
| molekulová hmotnost Na2CO3 | . . . | 105,99 u |
| 1 mol CO2 má objem. . . . . . . | . . . | 22,4 l |
| 1 mol Na2CO3 váží . . . . . . . . | . . . | 105,99 g |
| 105,99 g Na2CO3 | . . . | 22,4 l CO2 |
| 60 g Na2CO3 | . . . | x l CO2 |
| x = 12,68 l CO2 | ||
| Př. 4: Kolik litrů plynu se vytvoří při zahřívání 50 g vápence obsahujicího 80% uhličitanu vápenatého? |
| ve 100 g vápence | . . . | 80 g CaCO3 |
| v 50 g vápence . . | . . . | x g CaCO3 |
| x = 40 g CaCO3 | ||
| ze 100,99 g CaCO3 se vytvoří | . . . | 22,4 l CO2 |
| z 40 g CaCO3 se vytvoří . . . . | . . . | x l CO2 |
| x = 8,95 l CO2 | ||
| Př. 5: Kolik gramů CuSO4 . 5 H2O je nutno vzít pro přípravu 250 ml 0,4 M roztoku? |
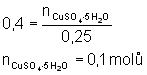
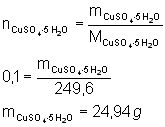
| Př. 6: Kolik gramů 5% roztoku hydroxidu sodného potřebujeme vzít pro neutralizaci 50 g 10% roztoku kyseliny trihydrogenfosforečné? |
| molekulová hmotnost 3 NaOH . | . . . 119,99 u |
| molekulová hmotnost H3PO4 . . . | . . . 97,99 u |
| 3 moly 3 NaOH váží . . . . . . . . . . | . . . 119,99 g |
| 1 mol H3PO4 váží . . . . . . . . . . . | . . . 97,99 g |
| 119,99 g NaOH | . . . | 97,99 g H3PO4 |
| x g NaOH . . . . | . . . | 5 g H3PO4 |
| x = 6,12 g 100% NaOH | ||
| Př. 7: Kolik gramů rtuti a kolik litrů kyslíku (za normálních podmínek) vznikne ze 108 g HgO? |
| molekulová hm.HgO . . | . . . 216,59 u | . . . váha 1 molu je 216,59 g |
| molekulová hm. Hg . . . | . . . 200,59 u | . . . váha 1 molu je 200,59 g |
| objem O2 . . . . . . . . . . . | . . . 22,4 dm3 |
| ze 2 molů HgO se vytvoří | . . . | 2 moly Hg a | . . . | 1 mol O2 |
| z 433,18 g HgO se vytvoří | . . . | 401,18 g Hg a | . . . | 22,4 dm3 O2 |
| x = 108 . 401,18 : 433,18 = 100,02 | ||||
| y = 108 . 22,4 : 433,18 = 5,58 | ||||
| Př. 8: Kolik ml 20% HCl je zapotřebí k reakci 2 g zinku s kyselinou? (r20% HCl = 1,1 g/cm3) |
| hmotnost 2 molů HCl . . | . . . 72 g |
| hmotnost 1 molu Zn . . . | . . . 65,38 g |
| z 72 g HCl | . . . | 65,38 g Zn |
| z x g HCl . . | . . . | 2 g Zn |
| Př. 9: Kolik molů vody vznikne při redukci 200 gramů CuO vodíkem? |
| hmotnost 1 molu CuO . . . | . . . 79,54 g |
| hmotnost 1 molu H2O . . . | . . . 18 g |
| z 79,54 g CuO | . . . | 18 g H2O |
| z 200 g CuO . . . | . . . | x g H2O |
| Př. 10: Rozpustí se všechen oxid měďnatý při rozpouštění 20 g CuO v roztoku, který obsahuje 21 gramů H2SO4? |