Vodík
| Název český | Vodík |
|---|
| Název latinský | Hydrogenium |
|---|
| Název anglický | Hydrogen [,haidredžen] |
|---|
| Značka | H |
|---|
| Protonové číslo | 1 |
|---|
| Hmotnostní číslo | 1,0079 |
|---|
| Oxidační číslo | 0, I, -I |
|---|
| Elektronegativita | 2,2 |
|---|
| Teplota tání °C | -259,3 |
|---|
| Teplota varu °C | -252,7 |
|---|
Zajmavé jednou větou
... vodík objevil v roce 1766 anglický chemik a fyzik Henry Cavendish [Kevendýš]
... z každých 100 atomů zemské kůry 17 patří vodíku
… 76 % kosmické hmoty pripadá na vodík
... každou sekundu se na Slunci změni na energii kolem 4 milionů tun vodíku
... pri "spalování" 1 g jader vodíku se uvolní energie 20 milionu krát vetší, než pri spalování stejného množství uhlí
... vodíku na Slunci stačí na 30 miliard let
… relativní hmotnost vodíku stanovená s fantastickou presností: 1,007276470
V přírodě se vodík vyskytuje jako směs tří izotopů s hmotnostními čísly 1, 2 a 3:
- protium - lehký vodík
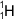 .
.
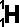
Molekuly přírodní vody obsahují dva izotopy vodíku: tzv. a tzv. těžký vodík neboli deuterium 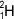 (
(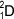 ), označovaný častěji zvláštní značkou D. Asi na 5000 atomů lehkého vodíku připadá 1 atom deuteria. Deuterium je součástí molekul tzv. těžké vody D2O. V jádře atomu obsahuje kromě 1 protonu i 1 neutron. Účinkem kosmického záření a při výbuchu vodíkové bomby vzniká další izotop vodíku - tritium
), označovaný častěji zvláštní značkou D. Asi na 5000 atomů lehkého vodíku připadá 1 atom deuteria. Deuterium je součástí molekul tzv. těžké vody D2O. V jádře atomu obsahuje kromě 1 protonu i 1 neutron. Účinkem kosmického záření a při výbuchu vodíkové bomby vzniká další izotop vodíku - tritium 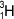 , běžně označovaný značkou T. Je radioaktivní. V jádře atomu obsahuje kromě jediného protonu také dva neutrony.
, běžně označovaný značkou T. Je radioaktivní. V jádře atomu obsahuje kromě jediného protonu také dva neutrony.
Fyzikální vlastnosti
Vodík je za normálních podmínek plyn bez barvy, zápachu a chuti. Je nejlehčí ze všech látek (14krát lehčí než vzduch) na Zemi. Lehké molekuly vodíku se pohybují s obrovskou rychlosti, zhruba 1800 m/s, a proto jeho tepelná vodivost je velmi vysoká - sedmkrát větší než u vzduchu.
Rozpustnost
Ve vodě se vodík nepatrně rozpustí (v 1 litru vody při 0°C a tlaku 0,1 MPa jen 22 ml plynného vodíku). Lépe se rozpouští v niklu, palladiu a v platině. Při rozpouštění v těchto kovech se molekuly vodíku štěpí na atomy. Atomární (rozštěpený na atomy) vodík je reaktivnější než molekulový, proto reakce vodíku za přítomnosti těchto kovů probíhají rychleji. Nikl, palladium a platina jsou proto výbornými katalyzátory.
H2
Atomy vodíku jsou složeny z jednoho protonu a jednoho elektronu. Atomy se sdružují do dvojic, vytvářejí dvouatomové molekuly H2. Molekuly vodíku jsou tak nepatrné, že procházejí pórovitými látkami, např. neglazovanými střepy, blánami a stěnami gumových hadic.
Chemické vlastnosti
Chemické vlastnosti vodíku vyplývají ze stavby jeho atomů a z jeho postavení v periodickém systému.
Při slučování vodíku se elektronový obal jeho atomů může upravit podle nejbližšího vzácného plynu dvojím způsobem:
1. Přibráním jednoho elektronu nabude atom vodíku elektronový obal vzácného plynu helia, čimž se atom vodíku mění na aniont H-.
2. Ztrátou jediného elektronu se atom vodíku mění na proton, kationt vodíku H+ bez elektronového obalu právě tak jako neutron, který se považuje za nultý prvek, a zařazuje se někdy do periodického systému mezi vzácné plyny značkou Nn.
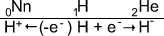
Proton (kationt vodíku H+) nemůže samostatně existovat. Při reakcích ve vodných roztocích se ihned váže na volný elektronový pár kyslíku nejbližší molekuly vody, a tím se vytvoří kationt oxonium H3O+:
H+ + H2O  H3O+
H3O+
Se zapisováním iontů H3O+ jsou v chemických rovnicích těžkosti, proto se používá zjednodušené zapisování H+.
Reakce s nekovy
Za obyčejné teploty se vodík slučuje s fluorem na fluorovodík HF, a to i za tmy. S chlorem tvoří chlorovodík HCl jen na slunečním světle účinkem ultrafialových paprsků nebo když směs zapálíme. Ve směsi se vzduchem nebo kyslíkem se slučuje po zapálení na vodu:
2 H2 + O2  2 H2O
2 H2O
Reakce probíhá velmi prudce, výbušně. Teplota kyslíkového plamene je velmi vysoká (až 2800°C). Proto se ho používá na svaření a řezání kovu.
Při vyšší teplotě a za přítomnosti katalyzátoru se vodík slučuje s dusíkem na amoniak:
3 H2 + N2  2 NH3
2 NH3
Z něho se dále vyrábí kyselina dusičná a dusíkatá hnojiva.
Reakce s kovy
S alkalickými kovy a s kovy alkalických zemin
se vodík slučuje na tuhé hydridy, v kterých vodík je aniontem H-, např. NaH, CaH2.
Výskyt
Molekulový vodík H2 vyskytuje se v malém množství ve vyšších vrstvách atmosféry. Většinou je vázaný ve sloučeninách: ve vodě, v hydridech, ve všech
kyselinách a hydroxidech a ve většině organických sloučenin.
Využití
Velmi čistý vodík se používá k výrobě umělých tuků a olejů. Vodík je důležitou průmyslovou surovinou také pro výrobu umělého benzínu z uhlí nebo z oxidu uhelnatého při výrobě methanolu apod.