pH
pH je hodnota, která ukazuje na množství kationtů vodíků v roztoku.
Voda, jako slabý elektrolyt, disociuje v malé míře podle rovnice:
H2O
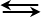 H+ + OH-
H+ + OH-
Jak vidíme, při disociaci se tvoří stejný počet kationtů vodíku H+ (určují kyselé vlastností roztoku) a aniontů OH- (určují zásadité vlastností roztoku), které se navzájem neutralizují. Proto říkáme, že voda není ani kyselá ani
zásaditá, ale neutrální.
Označíme:
[H+] - koncentrace kationtů H+
[OH-] - koncentrace aniontů OH-
[H+] = [OH-]
Pamatujte:
[H+] . [OH-] = K
K - konstantní (stálá) hodnota
K se za normálních podmínek rovná: K = 10-14
Za K dosadíme její hodnotu:
[H+] . [OH-] = 10-14
10-7 . 10-7 = 10-14
Jak vidíme, ve vodě (destilované) koncentrace H+ se rovná 10-7M = 0,0000001M. Jinými slovy, jestliže koncentrace H+ v roztoku se rovná 10-7M, prostředí je neutrální.
Příklad 1:
Čemu se rovná koncentrace iontů H+ v 0,001M roztoku HCl (budeme považovat, že HCl disociuje na 100%)?
[H+] = 10-3M
10-3 . [OH-] = 10-14
[OH-] = 10-11M
Výpočty ukazují, že koncentrace iontů vodíku je mnohonásobně vyšší než koncentrace hydroxoskupin. Toto znamená, že roztok je kyselý.
Příklad 2:
Čemu se rovná koncentrace iontů H+ v 0,01M roztoku NaOH (budeme považovat, že NaOH disociuje na 100%)?
[OH-] = 10-2M
[H+] . 10-2 = 10-14
[H+] = 10-12M
Výpočty ukazují, že koncentrace hydroxoskupin je mnohonásobně vyšší než koncentrace vodíku. Toto znamená, že roztok je zásaditý.
Pamatujte:
[H+] = 10-7 - prostředí neutrální
[H+] > 10-7 - prostředí kyselé
[H+] < 10-7 - prostředí zásadité
Mohly jste si všimnout nepohodlných čísel typu 10-12 nebo 10-11, a proto bylo dohodnuto
používat místo koncentraci vodíků její záporný logaritmus, který se označuje jako pH.
pH = - lg [H+].
lg - logaritmus
Pamatujte:
lg 10n = n
lg 105 = 5
lg 10-10 = -10
-lg 10-10 = 10
Teď zopakujeme:
[H+] = 10-7M
pH = -lg 10-7 = 7 - prostředí neutrální
[H+] = 10-5M
pH = -lg 10-5 = 5 - prostředí kyselé
[H+] = 10-10M
pH = -lg 10-10 = 10 - prostředí zásadité
Příklad 3:
Jaké je prostředí a jaké je pH 0,1M roztoku HNO3 (předpokládáme 100% disociaci)?
[H+] = 0,1M = 10-1M
pH = - lg 10-1 = 1 - kyselé prostředí
Příklad 4:
Jaké je prostředí a jaké je pH 0,1M roztoku KOH (předpokládáme 100% disociaci)?
[OH-] = 10-1M
10-1 . [H+] = 10-14
[H+] = 10-13M
pH = - lg 10-13 = 13 - zásadité prostředí


